Partikel Penyusun Inti Atom, Massa Atom, Gaya, Defek Massa, Ukuran dan Bentuk, Energi Ikat, Stabilitas, Rumus, Contoh Soal, Jawaban - Salah satu bahan bakar dalam stasiun pembangkit tenaga nuklir adalah uranium. Uranium merupakan salah satu unsur radioaktif yang memiliki nomor atom tertinggi dari semua unsur atom. Energi dihasilkan ketika intinya membelah membentuk unsur-unsur lain. Selain uranium, masih banyak lagi unsur radioaktif yang sangat berguna bagi kita, karena unsur radioaktif adalah unsur yang mudah meluruh membentuk unsur lain. Nah, untuk mengetahui tentang unsur radioaktif dan reaksi pembelahan atau peluruhannya ikuti pembahasan berikut ini.
 |
| Gambar 1. Reaktor nuklir menggunakan unsur radioaktivitas. [1] |
Inti atom merupakan partikel yang memiliki massa dan bermuatan positif. Sifat-sifat utama dari atom secara keseluruhan akan memengaruhi sifat zatnya. Jadi, untuk mengetahui sifat-sifat molekul suatu zat akan lebih baik jika kita mempelajarinya mulai dari struktur inti zat yang bersangkutan.
Struktur inti terdiri atas proton dan neutron yang disebut nukleon. Pada tahun 1911, berdasarkan eksperimen yang dilakukannya, Rutherford berpendapat bahwa muatan positif atom dikonsentrasikan di pusat atom sebagai inti atom. Kemudian, ia melakukan eksperimen dengan menembakkan partikel alfa pada atom yang diamati. Berdasarkan pengamatannya, partikel yang ditembakkan dihamburkan. Dari percobaan hamburan ini diambil kesimpulan mengenai distribusi muatan listrik yang ada di dalam atom sasaran. Pada saat itu, Rutherford belum bisa menjelaskan tentang kestabilan inti atom sehingga gerak elektron di dalam atom belum bisa dijelaskan. Tidak lama kemudian Niels Bohr mengembangkan teori mengenai struktur atom berdasarkan penemuanpenemuan terdahulu. Sampai sekarang model atom Bohr-Rutherford terus dikembangkan dalam fisika nuklir.
1. Partikel Penyusun Inti Atom
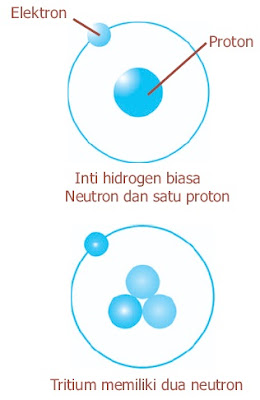
Semua atom dapat diidentifikasi berdasarkan jumlah proton dan neutron yang dikandungnya. Jumlah proton dalam inti setiap atom suatu unsur disebut nomor atom (Z).
Dalam suatu atom netral jumlah proton sama dengan jumlah elektron, sehingga nomor atom juga menandakan jumlah elektron yang ada dalam atom. Nomor massa (A) adalah jumlah total neutron dan proton yang ada dalam inti atom suatu unsur. Secara umum sebuah inti atom dinotasikan:
 |
| Gambar 2. Struktur inti atom. |
Jumlah neutron dalam suatu atom sama dengan selisih antara nomor massa dan nomor atom, atau A – Z. Sebuah atom memiliki tiga komponen dasar yang sangat penting yaitu elektron, proton, dan neutron. Tabel 1. menunjukkan massa dan muatan dari ketiga partikel tersebut.
Tabel 1. Massa dan muatan partikel subatom
Partikel
|
Massa (g)
|
Muatan
| |
Coulomb
|
Satuan Massa
| ||
Elektron
|
9,10939 x 10-28
|
- 1,6022 x 10-29
|
-1
|
Proton
|
1,67262 x 10-24
|
+ 1,6022 x 10-29
|
+1
|
Neutron
|
1,67493 x 10-24
|
0
|
0
|
1.1. Massa Atom
Massa suatu atom berhubungan erat dengan jumlah elektron, proton, dan neutron yang dimiliki atom tersebut. Berdasarkan perjanjian internasional, satu atom dari isotop karbon (disebut karbon-12) yang mempunyai enam proton dan enam neutron memiliki massa tepat 12 satuan massa atom (sma). Atom karbon-12 ini dipakai sebagai standar, sehingga satu satuan massa atom didefinisikan sebagai suatu massa yang besarnya tepat sama dengan seperduabelas massa dari satu atom karbon-12. Massa satu atom karbon-12 = 1 sma.
1 sma = massa satu atom karbon-12 / 12 = 1,66056 × 10-27 kg
Satuan massa atom juga dapat dinyatakan berdasarkan prinsip kesetaraan massa dan energi yang dikemukakan oleh Einstein. Sehingga diperoleh:
Inti sebuah massa atom hampir mengandung seluruh massanya. Hal ini karena inti merupakan tempat terkonsentrasi seluruh massa atom (sesuai model atom Rutherford). Alat yang dapat digunakan untuk mengukur massa atom disebut spektrometer massa, seperti yang ditunjukkan pada Gambar 3.
 |
| Gambar 3. Skema spektrometer massa. |
Pada sebuah spektrometer massa, suatu sampel gas ditembak oleh aliran elektron berenergi tinggi. Tumbukan antara elektron dan atom (atau molekul) gas menghasilkan ion positif dengan terlepasnya satu elektron dari tiap atom atau molekul. Ion-ion tersebut sampai pada sebuah detektor, yang mencatat arus listrik dari tiap jenis ion.
Jumlah arus listrik yang dihasilkan sebanding dengan jumlah ion, sehingga dapat ditentukan kelimpahan relatif dari isotop-isotopnya.
1.2. Defek Massa
Defek massa menunjukkan selisih antara massa diam sebuah inti atom dan jumlah seluruh massa diam masing-masing nukleonnya dalam keadaan tak terikat. Jadi, defek massa adalah kesetaraan massa energi ikat berdasarkan persamaan massa-energi.
Isotop dengan jumlah proton Z dan jumlah neutron (A – Z ) memiliki massa inti sebesar:
mi = Z.mp + (A – Z ) mn ...................................... (1)
Dengan mp adalah massa proton dan mn adalah massa neutron. Berdasarkan pengukuran diperoleh hasil bahwa massa inti atom lebih kecil daripada massa nukleon. Menurut hukum kesetaraan massa dan energi, besarnya defek massa dinyatakan:
m = Z.mp + (A – Z ) mn – mi ................................. (2)
Defek massa atau susut massa timbul karena untuk menyusun inti diperlukan energi yang mengikat semua nukleon, yang disebut energi ikat (binding energy), yang diperoleh dari massa inti. Berdasarkan teori relativitas Einstein mengenai kesetaraan antara massa dan energi diberikan oleh:
ΔE = (Δm). c2 ......................................................... (3)
dengan c adalah kecepatan cahaya.
Derek massa Δm dinyatakan dalam sma, maka energi ikat Δe dirumuskan: ΔE = Δm (931 MeV/sma)
1.3. Ukuran dan Bentuk Inti Atom
Eksperimen hamburan Rutherford membuktikan bahwa inti mempunyai ukuran dan bentuk. Volume inti berbagai atom mempunyai nilai yang berbanding lurus dengan banyaknya nukleon yang dikandungnya. Hal ini berarti kerapatan nukleonnya hampir sama dalam bagian dalam inti. Inti atom tidak mempunyai permukaan yang jelas. Meskipun demikian, sebuah inti atom tetap mempunyai jari-jari rata-rata. Jari-jari inti bergantung pada massa, jumlah proton, dan neutron. Jari-jari inti dirumuskan secara empiris sebagai suatu pendekatan, yaitu:
R = R0. A1/3 ...................................................... (4)
dengan:
A = nomor massa atom
R = jari-jari inti (fm)
R0 = 1,2 × 10-15 m
Inti suatu atom telah kita anggap sebagai bola. Tetapi, pada kenyataannya beberapa inti atom mempunyai distribusi muatan tidak simetri bola. Oleh karena volume bola berbanding lurus dengan R 3, maka persamaan (4) menunjukkan bahwa volume inti berbanding lurus dengan nomor massanya. Karena itu, untuk semua inti kecepatannya berbanding lurus dengan AR 3, sehingga dengan pendekatan tertentu, semua inti mempunyai kerapatan yang sama, yaitu:
Kerapatan inti mempunyai nilai konstan di bagian dalam inti dan nilai tersebut akan berkurang menuju nol di seluruh daerah permukaan yang kabur.
Sifat-sifat kimia karbon ditentukan oleh enam muatan negatifnya. Dalam atom karbon-12, inti juga mempunyai enam neutron, yang massanya kira-kira sama dengan proton, membuat bilangan massa atom 12.
Contoh Soal 1 :
Contoh Soal 1 :
Berapakah kerapatan inti dari?
Penyelesaian:
1.4. Energi Ikat Inti dan Stabilitas Inti Atom
Pada umumnya, inti yang memiliki nukleon yang lebih besar memiliki tingkat stabilitas inti yang rendah. Sehingga, tingkat stabilitas suatu inti ternyata tidak selalu ditentukan oleh besarnya energi ikat inti.
 |
| Gambar 4. Energi ikat per nukleon unsur-unsur dengan nomor atom. |
En = E/A
dengan:
En = energi ikat per nukleon (MeV)
E = energi ikat inti (MeV)
A = jumlah nukleon
1.5. Gaya Inti Atom
Gaya Inti adalah gaya yang mengikat nukleonnukleon, dengan kata lain gaya antarnukleon. Gaya Inti ternyata amat kuat tetapi jangkauannya amat pendek, dan tidak tergantung jenis nukleon, yaitu gaya antara proton dengan proton sama dengan gaya antara proton dengan neutron, maupun antara neutron dengan neutron. Ini berarti, bahwa gaya inti tidak bergantung pada muatan listrik nukleon (charge independent). Selanjutnya, ternyata gaya inti itu bersifat jenuh (saturated), yaitu setiap nukleon hanya tarik-menarik dengan nukleon di sekitarnya, seperti halnya gaya Van der Walls antarmolekul cairan. Sifat jenuh gaya inti ini diamati berdasarkan kejenuhan tenaga ikat per nukleon yang sekitar 8 MeV untuk semua unsur yang bilangan massanya A melebihi 60, seperti yang diperlihatkan oleh grafik pada Gambar 11.3.
Contoh Soal 2 :
Massa assa atom adalah 15,995 sma; hidrogen 1,0078 sma; dan neutron 1,0087 sma. Tentukan:
a. massa total partikel pembentuk,
b. defek massa,
c. energi ikat inti oksigen,
d. energi ikat rata-rata per nukleon!
Penyelesaian:
Besaran yang diketahui:
mi = 15,995 sma
mp = mH = 1,0078 sma
mn = 1,0087 sma
Z = 8
A = 16
neutron = A – Z = 16 – 8 = 8
a. Massa total nukleon = massa total proton + massa total neutron
= 8 mp + 8 mn
= 8 (mp + mn)
= 8 (1,0078 + 1,0087)
= 16,132 sma
b. m = Z.mp + ( A – Z ) mn – mi
= 8 (1,0078) + (16 – 8) (1,0087) – 15,995
= 0,137 sma
c. E = m (931 MeV/sma)
= (0,137 sma) (931,5 MeV/sma)
= 127,62 MeV
d. En = E/A = 127,62 MeV / 16 nukleon = 7,97625 MeV/nukleon





Tidak ada komentar:
Posting Komentar